Überangebot mit Folgen
28.07.2016Was bringt gesunde Zellen dazu, sich in Tumorzellen zu verwandeln und unkontrolliert zu vermehren? Wissenschaftler der Universität Würzburg haben die Rolle eines besonderen Proteins in diesem Prozess untersucht – und dabei die Antwort auf einen alten Streit gefunden.
Der Transkriptionsfaktor Myc trägt ein doppeltes Gesicht: Auf der einen Seite ist das Protein unerlässlich für das Wachstum und die Vermehrung von Zellen. Auf der anderen Seite findet es sich in so gut wie jeder Krebszelle – allerdings in einer deutlich erhöhten Konzentration. Die Vermutung, dass Myc eine tragende Rolle spielt, wenn Zellen entarten, liegt also auf der Hand. Wie dieser Prozess detailliert vonstattengeht, darüber gibt es bislang jedoch unterschiedliche Theorien.
Studie am Biozentrum der Uni Würzburg
Eine neue Studie Würzburger Wissenschaftler zeichnet nun ein neues Bild von den Vorgängen im Zellinneren. Demnach ist eine hohe Konzentration der Myc-Proteine Voraussetzung dafür, dass Tumoren entstehen. Entstanden ist diese Studie am Lehrstuhl für Biochemie und Molekuarbiologie (Vorstand: Prof. Dr. Martin Eilers) der Universität Würzburg; verantwortlich dafür ist der Nachwuchsgruppenleiter Dr. Elmar Wolf.
„Wir haben mit Zellen gearbeitet, die zum einen ein sehr geringes Myc-Level besitzen und die zum anderen molekularbiologisch gut verstanden sind“, sagt Elmar Wolf. In diesen Zellen haben die Wissenschaftler nach und nach die Myc-Konzentration künstlich erhöht und anschließend die Folgen untersucht. Ihre Befunde haben sie dann in echten Tumoren validiert.
Die Konzentration regelt die Funktion
„Der bisherigen Lehrmeinung nach aktiviert der Transkriptionsfaktor Myc eine Reihe von Genen, die für Zellwachstum und -teilung verantwortlich sind“, erklärt Wolf. Etwa im Darm: Dort sind die Zellen, die die Schleimhaut bilden, so gefordert, dass ihre Lebenszeit extrem kurz ist. Ungefähr einmal pro Woche muss sich deshalb die Darmschleimhaut komplett erneuern – was unter normalen Myc-Konzentrationen problemlos geschieht. Wird in einer Zelle Myc jedoch im Übermaß produziert, seien auch diese Gene deutlich aktiver; die Zelle verwandelt sich zur Tumorzelle – so die bisherige Annahme. Eine Sichtweise, die Elmar Wolf nicht teilt: „In Wirklichkeit sind die Vorgänge nicht so einfach.“
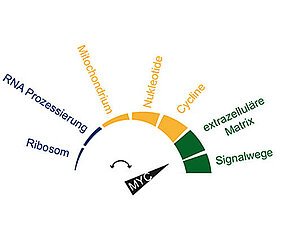
Tatsächlich aktiviert Myc in der Realität in Tumorzellen nicht nur die bekannten Gene. Wie Wolf und sein Team zeigen konnten, dockt das Protein mit steigender Konzentration an weitere Gene an und sorgt dafür, dass diese verstärkt abgelesen werden. „Myc bindet unter normalen Levels an bestimmte Gene mit einer hohen Affinität. Steigt jedoch der Level an, aktiviert es auch Gene mit einer niedrigen Affinität“, erklärt Wolf das Prinzip. Je nach Level fanden die Wissenschaftler unterschiedliche Genaktivierungsmuster, die jeweils unterschiedliche Prozesse in Gang setzten.
Wichtiger Beitrag für das Tumorwachstum
„Hohe Affinität“: Dazu gehören die Gene, die Zellwachstum und -teilung steuern. „Niedrige Affinität“: Hier aktiviert Myc Gene, die Prozesse steuern, die auf andere Weise das Tumorwachstum fördern. „Beispielsweise muss der Tumor mit Nährstoffen versorgt werden, damit er wachsen kann. Dazu benötigt er Blutgefäße“, erklärt Wolf. Und für die Bildung neuer Blutgefäße seien Gene zuständig, an die Myc erst dann andockt, wenn es in hoher Konzentration in der Tumorzelle vorhanden ist.
Migration ist ein weiteres Beispiel für solch einen Prozess, den Myc startet, indem es Gene mit einer niedrigen Affinität aktiviert. Er versetzt die Tumorzellen dazu in die Lage, sich auf Wanderschaft zu begeben und an anderer Stelle im Körper Tochtergeschwulste, sogenannte Metastasen, zu bilden.
Neuer Angriffspunkt in der Tumortherapie
Die Beobachtung, dass sich die Auswirkungen von Myc im gesunden Körper (Aktivierung von Genen mit „hoher Affinität“) und in Tumoren (Aktivierung von Genen mit „niedriger Affinität“) unterscheiden, eröffnet nach Ansicht der Wissenschaftler faszinierende neue Möglichkeiten in der Tumortherapie: „Wäre es möglich, die Funktion von Myc mit einem Medikament zu hemmen, so sollte es, in Anbetracht dieser Arbeit, eine Dosierung geben, bei der die tumorerzeugenden Eigenschaften von Myc gehemmt werden könnten, während die für das gesunde Gewebe wichtigen Funktionen von Myc erhalten blieben“, sagt Elmar Wolf.
Im Gegensatz zu klassischen Chemotherapeutika, die alle sich stark teilenden Gewebe, wie etwa die Darmwand, abtöten, wäre eine solche Tumortherapie dann deutlich nebenwirkungsärmer. Allerdings ist es bisher nicht möglich, die Myc-Funktion durch ein Medikament zu hemmen. Daran wird jedoch international intensiv geforscht.
Different promoter affinities account for specificity in Myc-dependent gene regulation. Francesca Lorenzin, Uwe Benary, Apoorva Baluapuri, Susanne Walz, Lisa Anna Jung, Björn von Eyss, Caroline Kisker, Jana Wolf, Martin Eilers, Elmar Wolf. DOI: 10.7554/eLife.15161.001
Nachgefragt
Herr Dr. Wolf: Sie haben Ihre neue Studie nicht, wie Ihre früheren Arbeiten, in einer bekannten Fachzeitschrift wie Nature oder Cancer Cell publiziert, sondern in eLife. Warum? Bei eLife handelt es sich ebenfalls um eine renommierte Fachzeitschrift, die in der Wissenschaft einen guten Ruf hat. Sie ist allerdings noch vergleichsweise jung.
Was unterscheidet eLife von den traditionellen Magazinen? Beispielsweise arbeitet die Redaktion nicht gewinnorientiert und verlangt keine Gebühren – weder fürs Veröffentlichen noch fürs Lesen. Ich als Autor bin außerdem völlig frei, was die Verwertbarkeit und Zugänglichkeit meiner Arbeit angeht. Ich kann sie etwa an Dritte verschicken oder auf meine Homepage setzen und für jedermann zugänglich machen. Außerdem arbeitet bei eLife kein festangestellter Editor, der eine Vorauswahl der Artikel trifft und dabei möglicherweise nicht nur wissenschaftliche Gründe berücksichtigt.
Aber ein Art Filter gibt es bei eLife doch hoffentlich auch? Natürlich. Nur handelt es sich hier um Wissenschaftler, die selbst noch aktiv sind. Für sie steht das Kriterium „exzellente Wissenschaft“ im Vordergrund.
Und wie sieht es mit dem Renommee aus? Bei eLife liegt der Fokus auf der Wissenschaft, nicht auf einem möglichst hohen Impact Factor. Ich habe unsere Arbeit dort eingereicht, weil ich das gesamte Konzept für richtig und unterstützenswert erachte.
Vielen Dank.
Kontakt
Dr. Elmar Wolf, Lehrstuhl für Biochemie und Molekularbiologie
T: (0931) 31-83259, elmar.wolf@biozentrum.uni-wuerzburg.de