Wie innere Uhren den Fettstoffwechsel steuern
11.09.2023Bei der Taufliege Drosophila steuern innere Uhren auch den Fettstoffwechsel. Das zeigt eine neue Studie eines Forschungsteams der Universität Würzburg. Die Erkenntnisse könnten auch für den Menschen relevant sein.
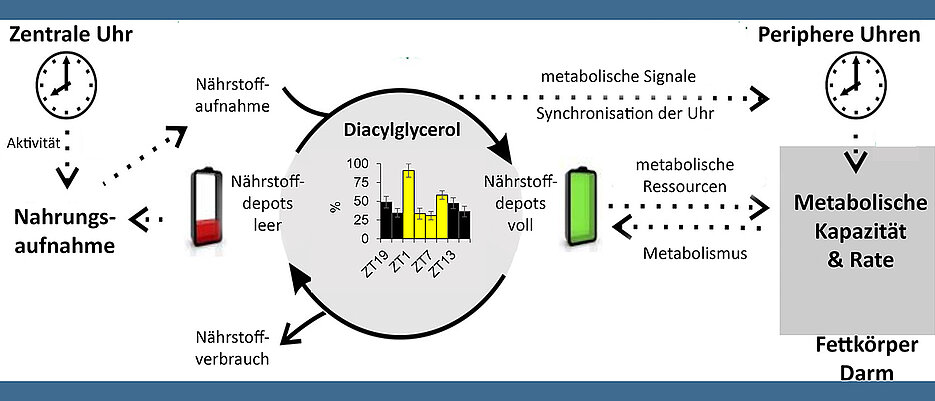
Viel ist darüber bekannt, wie der moderne Lebensstil des Menschen dazu beiträgt, Störungen im Stoffwechsel und Krankheiten auszulösen. Unregelmäßige Mahlzeiten, die Nahrungsaufnahme spät abends oder nachts und keine längeren Phasen der Abstinenz gelten inzwischen als wesentliche Faktoren für die Entwicklung des sogenannten „Metabolischen Syndroms“ – eines Krankheitsbilds, das unter anderem durch Fettleibigkeit und Bluthochdruck, einen erhöhten Blutzucker und eine Fettstoffwechselstörung gekennzeichnet ist. Die dafür verantwortlichen Mechanismen sind bislang allerdings nur unzureichend verstanden.
Das Wissen über einen gestörten Stoffwechsel vertiefen
Eine neue Studie von Wissenschaftlerinnen und Wissenschaftlern am Biozentrum der Julius-Maximilians-Universität Würzburg (JMU) könnte nun dazu beitragen, das Wissen über die gestörten Stoffwechselvorgänge zu vertiefen. In der Arbeit, die jetzt in der Fachzeitschrift Journal of Lipid Research erschienen ist, hat das Team untersucht, inwieweit innere Uhren den Fettstoffwechseln bei der Taufliege Drosophila steuern.
Verantwortlich für diese Studie waren Professor Christian Wegener vom Lehrstuhl für Neurobiologie und Genetik der JMU und Dr. Agnes Fekete, Managerin der Metabolomics Core Unit am Lehrstuhl für Pharmazeutische Biologie.
„Lipide, also Fette, sind Makro-Nährstoffe, die im Organismus beispielsweise als Bausteine für biologische Membranen, als Signalstoffe und als langfristige Energiespeicher dienen. Um ihre Zielzellen zu erreichen, müssen sie nach der Nahrungsaufnahme aus dem Darm oder bei der Mobilisierung aus den Fettspeichern über den Blutkreislauf transportiert werden“, beschreibt Agnes Fekete den Hintergrund der Studie.
Dieser „Kreislauf der Lipide“ könne allerdings durch den modernen Lebensstil gestört werden, wenn Schichtarbeit, unregelmäßige Essenszeiten und die permanente Verfügbarkeit von Nahrung nicht mit der Rhythmik übereinstimmen, die vom Tag-Nacht-Wechsel und damit synchronisierten inneren Uhren vorgegeben wird.
Eine innere Uhr stimmt den Lipidtransport auf die Siesta ab
Das Team um Wegener und Fekete hat deshalb am Beispiel der Taufliege untersucht, welchen regelmäßigen Schwankungen der Fettstoffwechsel bei diesem Insekt unterliegt, welche Rolle innere Uhren dabei spielen und wie sich Faktoren wie Licht, Nahrungsaufnahme und Nahrungszusammensetzung darauf auswirken. Ihr spezieller Blick galt dabei der sogenannten Hämolymphe – dem Analog zum Blutkreislauf des Menschen – und den darin transportieren Fettmolekülen.
Das zentrale Ergebnis fasst Wegener so zusammen: „Unsere Daten deuten darauf hin, dass die innere Uhr die täglichen Oszillationen der Transportlipide in der Hämolymphe auf die Ruhezeiten der Taufliege, die sogenannte anabole Siesta-Phase, abstimmt. Dabei zeigt sich jedoch ein starker Einfluss des Lichts auf den Verlauf und die Stärke dieser Oszillationen“, so der Neurobiologe.
Zum Einsatz kamen im Rahmen dieser Studie sowohl normale, gesunde Taufliegen, als auch Exemplare, bei denen die innere Uhr genetisch ausgeschaltet war. Diese wurden unter unterschiedlichen Lichtverhältnissen gehalten – mal in einem regelmäßigen Hell-Dunkel-Rhythmus, mal in konstanter Dunkelheit. Zusätzlich erhielten sie unterschiedliche „Diäten“ – von einem reinen Zuckermedium bis zum Standardmedium, das sämtliche Nährstoffe in reichlicher Menge enthielt.
Deutliches Indiz für eine von inneren Uhren gesteuerte Oszillation
Über die Hämolymphe kontrollierte das Team regelmäßig, in welcher Konzentration die Fliege bestimmte Lipide durch ihren Organismus transportierte. Dabei zeigten sich eindeutige Muster: Bei „gesunden“ Fliegen beispielsweise, die in einem Hell-Dunkel-Zyklus auf einem reinen Zuckermedium gehalten wurden, war die Konzentration der Lipide speziell zu Beginn und am Ende der Lichtphase hoch. Unter konstant dunklen Bedingungen zeigte sich nur noch ein Anstieg, immer in der Mitte des „subjektiven“ Tages. Bei Fliegen ohne funktionierende innere Uhr zeigten sich keine solche regelmäßigen Kurven.
Weniger deutlich ausgeprägt waren diese Kurven auch dann, wenn die Fliegen nicht nur Zucker, sondern eine quasi vollwertige Nahrung bekamen. In diesem Fall waren die rhythmischen Veränderungen der Hämolymph-Fettwerte stark abgeschwächt. Dass die Lipidkonzentrationen bei einer zeitlich begrenzten Fütterung unabhängig vom Zeitpunkt der Nahrungsaufnahme einmal in der Mitte der Lichtphase ihren Höhepunkt erreichten, werten die Wissenschaftlerinnen und Wissenschaftler als ein „deutliches Indiz für eine von inneren Uhren gesteuerte Oszillation“.
Ansatzpunkt für ein besseres Verständnis beim Menschen
Natürlich: Diese Vorgänge bei Drosophila unterscheiden sich in einigen Aspekten von denen beim Menschen oder bei anderen Säugetieren. Trotzdem ist das Team um Wegener und Fekete davon überzeugt, dass seine Arbeit als Ausgangspunkt dienen kann, um zugrundeliegende allgemeine Mechanismen mit den für Drosophila vorhandenen genetischen Werkzeugen detailliert zu untersuchen – und damit längerfristig auch einen Ansatzpunkt für das Verständnis der Prozesse und ihrer krankhaften Veränderungen beim Menschen bietet.
In einem nächsten Schritt wollen die Wissenschaftlerinnen und Wissenschaftler nun untersuchen, welche Rolle die innere Uhr im Darm und im Fettkörper – analog zu Leber und Fettgewebe beim Menschen – für die Rhythmizität spielen. Dafür wollen sie gezielt nur diese sogenannten peripheren Uhren genetisch ausschalten beziehungsweise gegenüber den anderen Körperuhren desynchronisieren. „Das wäre ein Modell, mit dem sich die Auswirkungen der Desynchronisation der Körperuhren beispielsweise durch eine nächtliche Nahrungsaufnahme im Tiermodell untersuchen lassen“, so Christian Wegener.
Originalpublikation
The circadian clock is required for rhythmic lipid transport in Drosophila in interaction with diet and photic condition. Kelechi M. Amatobi, Ayten Gizem Ozbek-Unal, Stefan Schäbler, Peter Deppisch, Charlotte Helfrich-Förster, Martin J. Mueller, Christian Wegener, Agnes Fekete. Journal of Lipid Research, https://doi.org/10.1016/j.jlr.2023.100417.
Kontakt
Prof. Dr. Christian Wegener, Lehrstuhl für Neurobiologie und Genetik, T: +49 931 31-85380, christian.wegener@biozentrum.uni-wuerzburg.de
Dr. Agnes Fekete, Lehrstuhl für Pharmazeutische Biologie, T: +49 931 31-84223, agnes.fekete@uni-wuerzburg.de